Tratamiento sistémico
Tratamiento sistémico para el BCC avanzado
El tratamiento sistémico reciente para pacientes con CCB avanzado o metastásico que no se puede tratar con métodos terapéuticos convencionales, incluye inhibidores de la vía Hedgehog e inmunoterapia, los cuales se han convertido en el concepto básico para el tratamiento de tumores cutáneos avanzados y metastásicos.
En poblaciones específicas, tales como los inmunosuprimidos, los ancianos, los que tienen un estado funcional basal deficiente y los casos de enfermedad metastásica, avanzada, recalcitrante o cosméticamente sensible, el tratamiento no quirúrgico puede ser una alternativa deseable.
Procesos metabólicos aberrantes
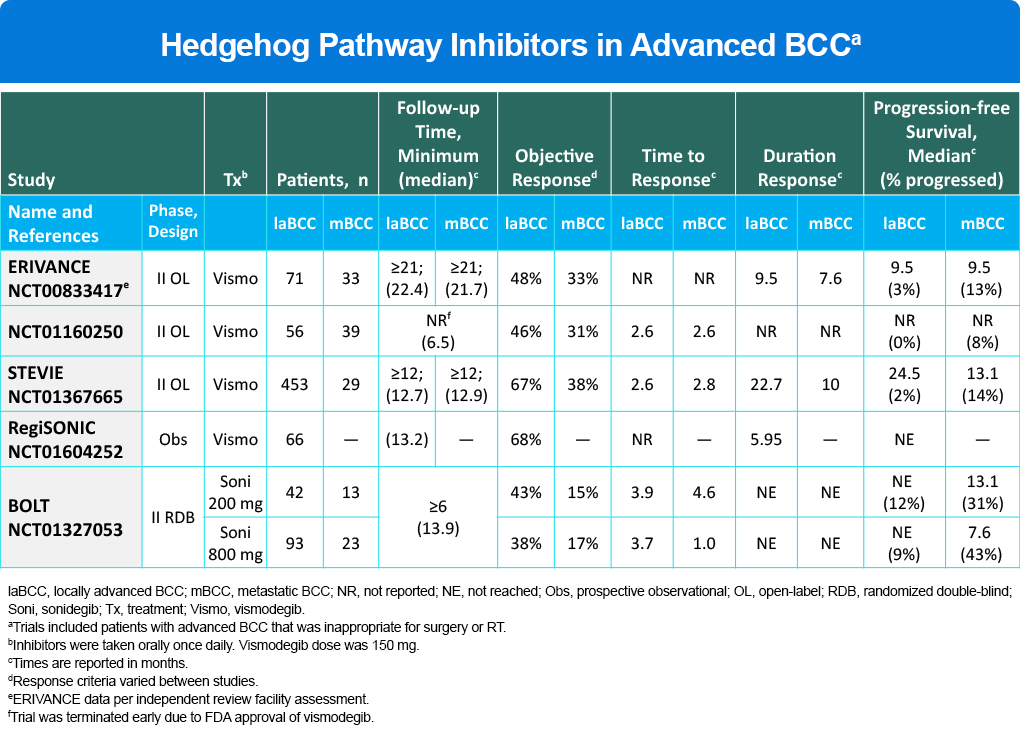
La señalización aberrante o anormal de la vía hedgehog es importante para la fisiopatología del BCC, ya que es un motor principal en la progresión y patogénesis de la enfermedad. Como diana terapéutica clave, dos inhibidores de la vía hedgehog, vismodegib y sonidegib, están indicados actualmente para el tratamiento del carcinoma de células basales localmente avanzado (laBCC, por sus siglas en inglés) en casos en los que la cirugía y la radioterapia son inapropiadas. En base a un seguimiento mínimo de 21 meses, la respuesta objetiva a vismodegib fue del 48% (laBCC) y del 33% (metastásico) (Tabla 1). También se aprobó un segundo inhibidor, sonidegib, en base a los datos del estudio BOLT con una ORR del 43% (laBCC) y del 15% (metastásico) para la dosis más baja (Tabla 1). Una limitación clave de estas terapias es el desarrollo de resistencia que limita la respuesta (Tabla 1). En estudios, tanto vismodegib como sonidegib demostraron EA graves que condujeron a la interrupción del 14% al 32% de los pacientes. Los efectos adversos comúnmente reportados con mayor frecuencia incluyeron náuseas, disgeusia, espasmos musculares, alopecia, pérdida de peso, diarrea y fatiga. Las pautas de la NCCN en el manejo de laBCC o enfermedad metastásica, establece que: “Debido a la frecuencia de efectos secundarios intolerables asociados con los inhibidores de la vía hedgehog, el descanso del medicamento u otras alternativas a la dosificación diaria pueden ser utilizados para reducir los efectos secundarios y mejorar la adherencia a la terapia y la calidad de vida”.
Tabla 1. Inhibidores de la Vía Hedgehog en el BCC Avanzado
Iniciación de la inmunidad contra el cáncer: Liberación de antígenos, presentación y cebado de Células T
Los intentos de activar o introducir células T antígeno-específicas del cáncer, así como de estimular la proliferación de estas células en los últimos 20 años han conducido a respuestas inmunitarias anticáncer en su mayoría nulas, mínimas o modestamente apreciables. En muchos tipos de cáncer humanos, el ciclo cáncer-inmunidad permanece intacto hasta el momento en que las células T matan a las células tumorales, lo que puede ser potentemente frenado por PD-L1. Una vez que se bloquea la interacción PD-L1/PD-1, las células T anticancerígenas preexistentes pueden recuperar rápidamente su función efectora.
Para aprovechar esta comprensión tanto de la vía de SHH como del sistema inmunitario en la tumorigénesis del BCC, se inscribió un pequeño estudio de 16 pacientes (9 con pembrolizumab solo, 7 con pembrolizumab/vismodegib). La ORR para todos los pacientes fue del 38% (44% para el pembrolizumab y 29% para la terapia dual), además de tres con RC (uno con pembrolizumab en monoterapia, dos con terapia dual). No se presentaron signos de toxicidad inesperada con la combinación, sin embargo no se percibieron señales claras de que la combinación de los dos agentes diera como resultado una eficacia mejorada.
Cemiplimab, un anticuerpo monoclonal contra PD-1, es la primera y actualmente la única inmunoterapia aprobada por la FDA contra el CCB. Ha demostrado eficacia con un perfil de seguridad comparable al de otros agentes anti–PD-1 en neoplasias malignas avanzadas. Los datos de 112 pacientes con BCC (84 localmente avanzados, 28 metastásicos) dieron lugar a la aprobación acelerada por parte de la FDA. Entre los 84 pacientes con laBCC, la ORR confirmada fue del 29%, y el 79% de los pacientes mantuvieron su respuesta durante al menos 6 meses. Entre los 28 con mBCC, la ORR confirmada fue del 21%, además todos los pacientes mantuvieron sus respuestas durante al menos 6 meses. Las reacciones adversas graves fueron inmunomediadas (p. ej., neumonitis, hepatitis, colitis, insuficiencia suprarrenal, hipotiroidismo e hipertiroidismo, diabetes mellitus y nefritis) y reacciones a la perfusión. Las reacciones adversas más frecuentes (incidencia ≥20%) fueron fatiga, dolor musculoesquelético, diarrea, erupción cutánea y prurito.
Figura 3. Terapias que afectan el ciclo inmunitario
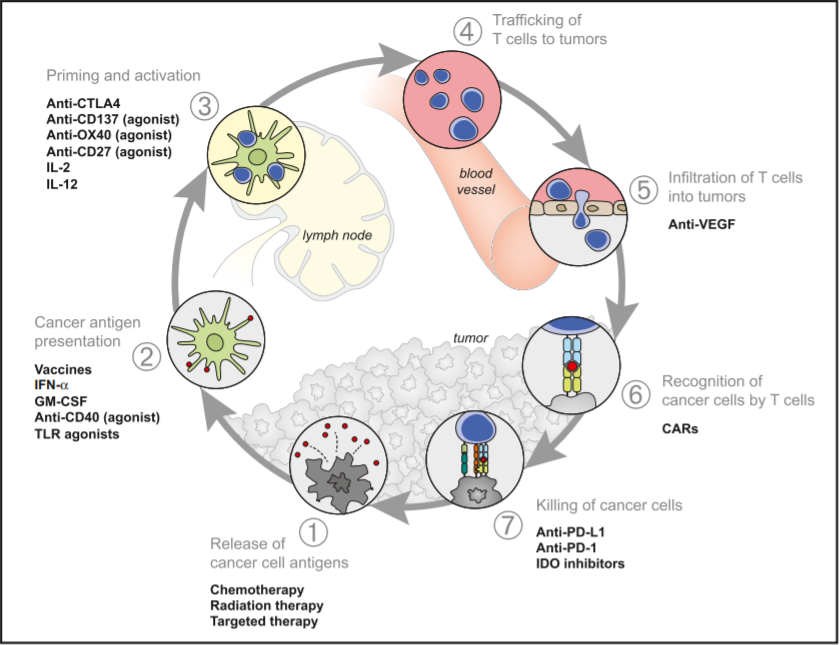
La quimioterapia y la radioterapia tienen una larga historia en el tratamiento del BCC, siendo su liberación de neoantígenos (Figura 3) un desencadenante bien reconocido para el sistema inmunitario del individuo. Más recientemente, la potenciación de los efectos inmunitarios antitumorigénicos ha tenido éxito con la aplicación clínica de inhibidores tanto de CTLA-4 como de PD-1/L1 en múltiples cánceres cutáneos. La inhibición de CTLA-4 está íntimamente implicada con el cebado y la activación de las células T (etapa 3), mientras que los efectos de los inhibidores de PD-1 y PD-L1 se observan más adelante en el ciclo inmunitario (etapa 7), lo que implica la revitalización de las células T de modo que reconozcan y eliminen eficazmente las células cancerosas.
Los inhibidores de los puntos de control inmunitario son una nueva y emocionante clase de productos terapéuticos que pronto pueden proporcionar a los médicos y pacientes una serie de opciones de tratamiento que superan con creces el uso de la quimioterapia.
Referencias
Bassett-Seguin N, Hauschild A, Grob JJ, et al. Vismodegib in patients with advanced basal cell carcinoma (STEVIE): A pre-planned interim analysis of an international, open-label trial. Lancet Oncol. 2015;16:729-736.
Chang AL, Solomon JA, Hainsworth JD, et al. Expanded access study of patients with advanced basal cell carcinoma treated with the Hedgehog pathway inhibitor, vismodegib. J Am Acad Dermatol. 2014;70:60-69.
Chang ALS, Tran DC, Cannon JGD, et al. Pembrolizumab for advanced basal cell carcinoma: An investigator initiated, proof-of-concept study. J Am Acad Dermatol. 2019;80:564-566.
Chen DS, Mellman I. Oncology meets immunology: The cancer-immunity cycle. Immunity. 2013;39:1-10.
Drucker AM, Adam GP, Rofeberg V, et al. Treatments of primary basal cell carcinoma of the skin: A systematic review and network meta-analysis. Ann Intern Med. 2018;169:456-466.
Lacouture M. The RegiSONIC disease registry: Preliminary effectiveness and safety in the first 66 newly diagnosed locally advanced basal cell carcinoma (BCC) patients treated with vismodegib. ASCO meeting abstracts. 2015;33:9023.
Lewis K, Peris K, Sekulic A, et al. 428 Interim analysis of Phase 2 results for cemiplimab in patients with metastatic basal cell carcinoma (mBCC) who progressed on or are intolerant to hedgehog inhibitors (HHIs). J Immunother Cancer. 2020;8(suppl 3):A260-A261.
Migden MR, Guminski A, Gutzmer R, et al. Treatment with two different doses of sonidegib in patients with locally advanced or metastatic basal cell carcinoma (BOLT): A multicenter, randomized, double-blind phase 2 trial. Lancet Oncol. 2015;16:716-728.
National Cancer Center Network. NCCN Clinical Practice Guidelines in Oncology. Basal Cell Skin Cancer. Version 1.2022 – November 17, 2021.
Sekulic A, Migden MR, Lewis K, et al. Pivotal ERIVANCE basal cell carcinoma (BCC) study: 12-month update of efficacy and safety of vismodegib in advanced BCC. J Am Acad Dermatol. 2015;72:1021-1026.e8.
Stenger M. Cemiplimab-rwlc for patients with locally advanced basal cell carcinoma. Asco Post. Published April 25, 2021. https://ascopost.com/issues/april-25-2021/cemiplimab-rwlc-for-locally-advanced-and-metastatic-basal-cell-carcinoma/
Zelin E, Zalaudek I, Agozzino M, et al. Neoadjuvant therapy for non-melanoma skin cancer: Updated therapeutic approaches for basal, squamous, and Merkel cell carcinoma. Curr Treat Options Oncol. 2021;22:35.





